Aldehído
Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al :
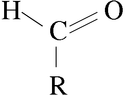 Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.
Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.Se pueden obtener a partir de la oxidación suave de los alcoholes primarios. Esto se puede llevar a cabo calentando el alcohol en una disolución ácida de dicromato de potasio (también hay otros métodos en los que se emplea Cr en el estado de oxidación +6). El dicromato se reduce a Cr3+ (de color verde). También mediante la oxidación de Swern, en la que se emplea dimetilsulfóxido, (DMSO), dicloruro de oxalilo, (CO)2Cl2, y una base. Esquemáticamente el proceso de oxidación es el siguiente:
Etimológicamente, la palabra aldehído proviene del latín científico alcohol dehydrogenatum (alcohol deshidrogenado).[1]
Propiedades
Propiedades físicas
- La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
- Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomérica.Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio, la reacción tiene que ser débil , las cetonas también se obtienen de la deshidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
Propiedades químicas
- Se comportan como reductor, por oxidación el aldehído de ácidos con igual número de átomos de carbono.
Nomenclatura
Se nombran sustituyendo la terminación -ol del nombre del hidrocarburo por -al. Los aldehídos más simples (metanal y etanal) tienen otros nombres que no siguen el estándar de la Unión Internacional de Química Pura y Aplicada (IUPAC) pero son más utilizados (formaldehído y acetaldehído, respectivamente) estos últimos dos son nombrados en nomenclatura trivial.| Número de carbonos | Nomenclatura IUPAC | Nomenclatura trivial | Fórmula | P.E.°C |
|---|---|---|---|---|
| 1 | Metanal | Formaldehído | HCHO | -21 |
| 2 | Etanal | Acetaldehído | CH3CHO | 20,2 |
| 3 | Propanal | Propionaldehído Propilaldehído | C2H5CHO | 48,8 |
| 4 | Butanal | n-Butiraldehído | C3H7CHO | 75,7 |
| 5 | Pentanal | n-Valeraldehído Amilaldehído n-Pentaldehído | C4H9CHO | 103 |
| 6 | Hexanal | Capronaldehído n-Hexaldehído | C5H11CHO | |
| 7 | Heptanal | Enantaldehído Heptilaldehído n-Heptaldehído | C6H13CHO | |
| 8 | Octanal | Caprilaldehído n-Octilaldehído | C7H15CHO | |
| 9 | Nonanal | Pelargonaldehído n-Nonilaldehído | C8H17CHO | |
| 10 | Decanal | Caprinaldehído n-Decilaldehído | C9H19CHO |
-Para nombrar aldehídos como sustituyentes
-Si es sustituyente de un sustituyente
Los aldehídos son funciones terminales, es decir que van al final de las cadenas Nomenclatura de ciclos
| Localizador | Cadena Carbonada Principal | Carbaldehido | Ejemplo |
|---|---|---|---|
| 1(se puede omitir) | Benceno | Carbaldehido | |
| 2,3 | Naftaleno | DiCarbaldehido |
–== Reacciones ==
Los aldehídos aromáticos como el benzaldehído se dismutan en presencia de una base dando el alcohol y el ácido carboxílico correspondiente:
2 C6H5C(=O)H → C6H5C(=O)OH + C6H5CH2OH
Con aminas primarias dan las iminas correspondiente en una reacción exotérmica que a menudo es espontánea:
R-CH=O + H2N-R' → R-CH=N-R'
En presencia de sustancias reductoras como algunos hidruros o incluso otros aldehídos pueden ser reducidos al alcohol correspondiente mientras que oxidantes fuertes los transforman en el correspondiente ácido carboxílico.
Con cetonas que portan un hidrógeno sobre un carbono sp³ en presencia de catalizadores ácidos o básicos se producen condensaciones tipo aldol.
Con alcoholes o tioles en presencia de sustancias higroscópicas se pueden obtener acetales por condensación. Como la reacción es reversible y los aldehídos se recuperan en medio ácido y presencia de agua esta reacción se utiliza para la protección del grupo funcional.
Usos
Los usos principales de los aldehídos son:Los aldehídos están presentes en numerosos productos naturales y grandes variedades de ellos son de la propia vida cotidiana. La glucosa por ejemplo existe en una forma abierta que presenta un grupo aldehído. El acetaldehído formado como intermedio en la metabolización se cree responsable en gran medida de los síntomas de la resaca tras la ingesta de bebidas alcohólicas.
El formaldehído es un conservante que se encuentra en algunas composiciones de productos cosméticos. Sin embargo esta aplicación debe ser vista con cautela ya que en experimentos con animales el compuesto ha demostrado un poder cancerígeno. También se utiliza en la fabricación de numerosos compuestos químicos como la baquelita, la melamina etc.
Reacciones de aldehídos
De Wikipedia, la enciclopedia libre
Las reacciones de aldehídos son las reacciones químicas en las que participan los aldehídos y que permiten su transformación en otros compuestos orgánicos.


Reacciones de aldehídos
1) Oxidación
Al reaccionar con un oxidante fuerte como el permanganato de potasio (KMnO4), el trióxido de cromo en medio ácido[1] (CrO3 / H3O+) o el reactivo de Tollens ([Ag(NH3)2]NO3) se produce un ácido carboxílico.2) Reducción
Por reducción con hidruro de aluminio y litio o borohidruro de sodio en etanol[1] se obtiene un alcohol primario.3) Hidratación
En medio acuoso forma un hidrato que por deshidratación puede ser transformado nuevamente en aldehído.4) Acetilación
En medio alcohólico ocurre la acetilación del carbonilo, el cual dependiendo de la concentración del alcohol puede ser hemiacetal o diacetal. El aldehído puede ser obtenido nuevamente por hidrólisis ácida de los acetales.[1]5) Reacción con reactivos de Grignard
En presencia de reactivos de Grignard ocurre la adición nucleofílica (AN) del alquiluro sobre el carbono carbonílico produciendose de esta manera un alcohol secundario.[1]6) Reacción de Wittig
Los reacción con reactivos de Wittig producen alquenos.[1]7) Condensación aldólica
En medio básico se produce la condensación aldólica formandose β-hidroxialdehídos; en medios ácidos a altas temperaturas se produce la hidrólisis del compuesto formandose aldehídos α,β insaturados.8) Adición de cianuro
Por reacción de cianuro de sodio en exceso en medio ácido (reacción altamente peligrosa) se produce las cianhidrinas; las cuales, mediante su hidólisis básica a altas temperaturas producen los α-hidroxiácidos.9) Formación de enaminas
Por sustitución nucleofílica (SN o AN+E) de aminas disustituídas en medio ácido se producen enaminas.[1]10) Formación de iminas
La reacción con aminas disustituídas en medio ácido produce iminas.[1]11) Formación de oximas
La reacción con hidroxilamina en medio ácido produce oximas.12) Formación de hidrazonas
La reacción con hidrazina en medio ácido produce hidrazonas.13) Reducción de Wolff-Kishner
Por reacción con hidrazina en medio básico con dimetil sulfóxido (DMSO) se produce la reducción del aldehído a alcano.[1]14) Formación de semicarbazonas
La reacción con semicarbazida en medio ácido produce semicarbazonas.Reacciones de caracterización de aldehídos
Las reacciones de caracterización de aldehídos permiten identificar el grupo formilo en los compuestos orgánicos.1) Reacción Schiff
El reactivo de Schiff reacciona con el grupo formilo formando un compuesto coloreado azul-violeta.
2) Reacción de Tollens
En presencia del reactivo de Tollens (nitrato de plata amoniacal) se produce la oxidación del aldehído a carboxilato de amonio y la precipitación de plata elemental, produciéndose la formación de un espejo en la superficie del recipiente de reacción.3) Reacción con 2,4-DNFH
La 2,4-dinitrofenilhidrazina reacciona con el grupo formilo formando un precipitado amarillo, naranja o rojo.




No hay comentarios:
Publicar un comentario